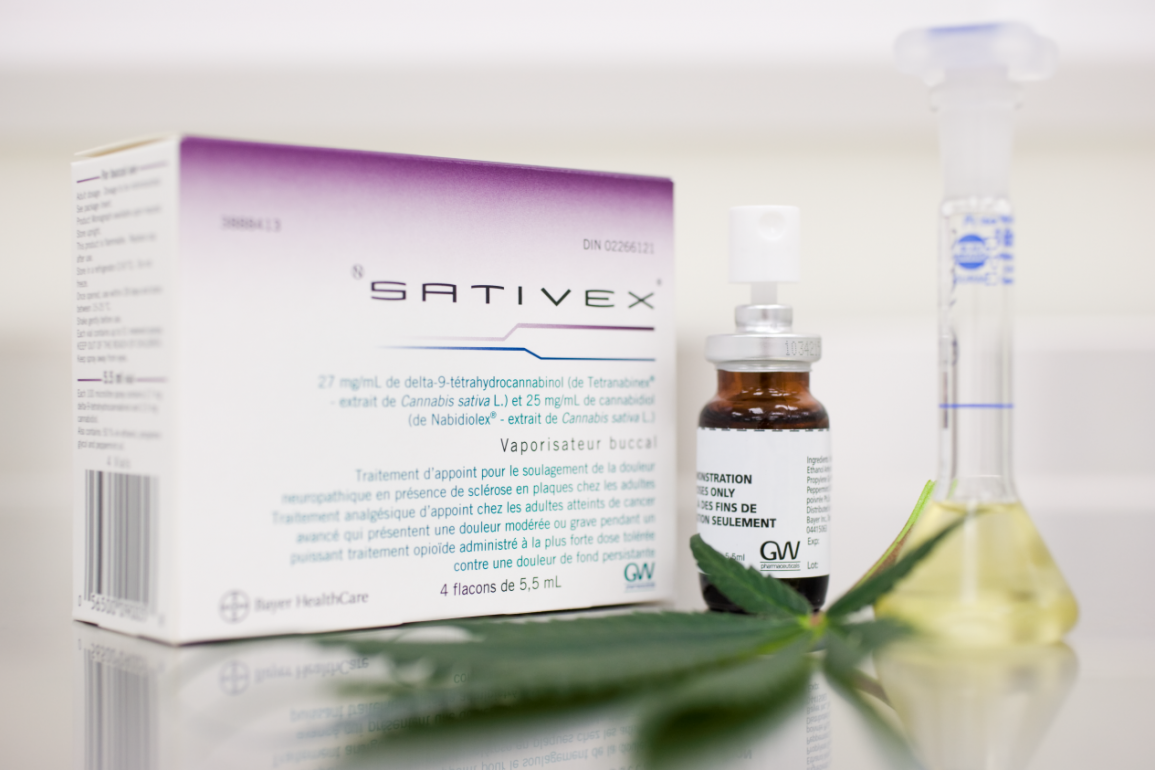
El Ministerio canadiense de Sanidad (Health Canada) ha dicho que el Sativex, extracto de cannabis del laboratorio británico GW Pharmaceuticals, reúne los requisitos necesarios para su autorización. El Sativex estará indicado en Canadá, en principio, para el dolor neurológico de la esclerosis múltiple.
La noticia llega apenas unas semanas después de conocerse que las autoridades británicas manifestaran que quieren más pruebas de la eficacia del medicamento antes de autorizarlo. En el Reino Unido el laboratorio había solicitado su comercialización para una indicación diferente: el tratamiento de la espasticidad en pacientes con esclerosis múltiple.
El Sativex es un extracto puro de la propia planta de cannabis que contiene, como principales componentes, los cannabinoides THC y CBD. El medicamento se administra por medio de un nebulizador bucal. En Canadá tendrá la exclusiva de su distribución Bayer HealthCare. El Ministerio canadiense de Sanidad ha confirmado que el Sativex cumple el baremo necesario para su aprobación. Ahora GW cuenta con un plazo de 30 días para decir si acepta las condiciones. Si lo hace, las autoridades continuarían con todo el proceso hasta su comercialización.
Los analistas dicen que, según el sistema canadiense que regula la aprobación de nuevos medicamentos, lo que queda para completar dicho proceso es mero trámite. GW espera el visto bueno total para comienzos del próximo año.
(Fuentes: Reuters del 21 de diciembre de 2004, Comunicado de prensa de GW Pharmaceuticals del 21 de diciembre de 2004)
Cortesía de IACM
Asociación Internacional por el Cannabis como Medicamento