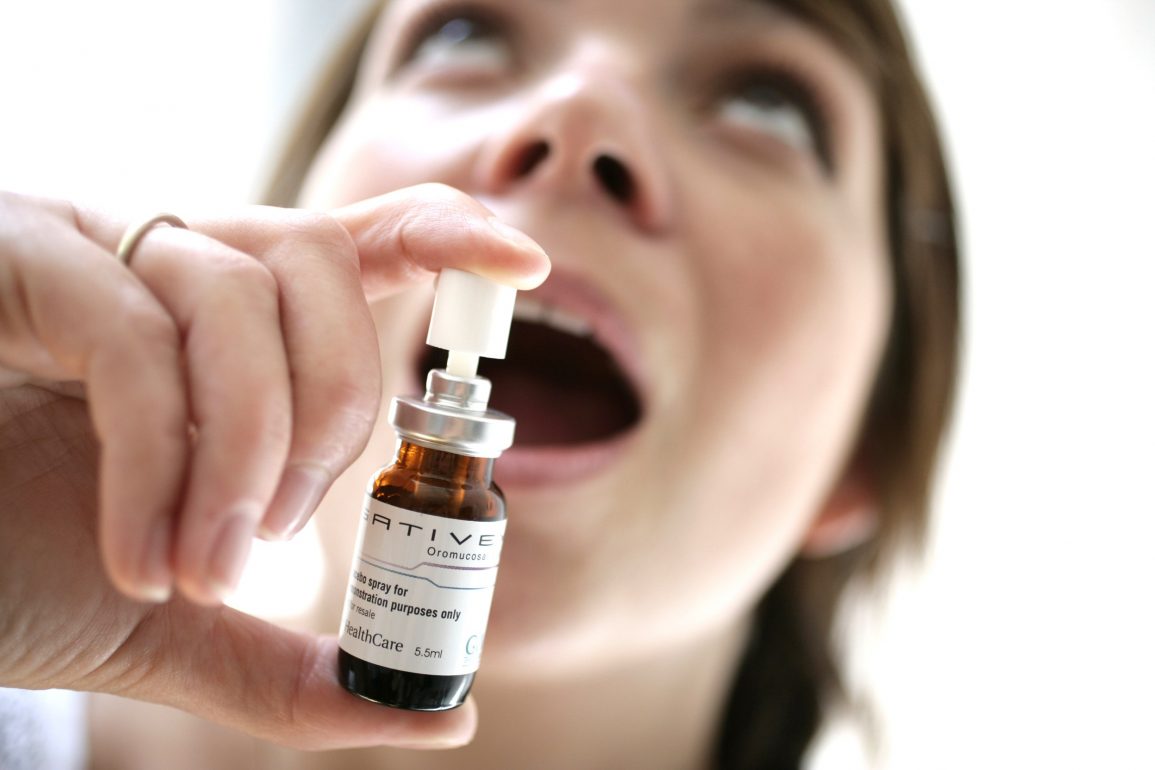
Se espera que el Sativex, medicamento basado en el cannabis para enfermedades como la esclerosis múltiple, consiga autorización para su comercialización en Gran Bretaña y España en el segundo trimestre de 2010, según dijo su fabricante GW Pharmaceuticals el 18 de marzo. La compañía afirmó que las autoridades de ambos países daban por concluidas las cuestiones relativas a calidad, seguridad y eficacia. Las conversaciones se centran ahora en temas como la confección del prospecto informativo al paciente.
El medicamento, que se administra pulverizado bajo la lengua, será comercializado en el Reino Unido por la empresa alemana Bayer y en el resto de EURopa por la española Almirall. GW obtendrá 10 millones de libras (15 millones de dólares norteamericanos) como pago de Bayer por la licencia británica, mientras que Almirall pagará en España otros 2’5 millones de libras cuando consiga la licencia de aprobación y se estipule su precio. Los ensayos clínicos han demostrado que el Sativex reduce la espasticidad en pacientes con esclerosis múltiple que no responden adecuadamente a los tratamientos disponibles. GW esperaba inicialmente conseguir la aprobación de su medicamento en 2003, pero una serie de retrasos legales en EURopa han dificultado el proceso. Los analistas estiman picos de ventas de Sativex en la esclerosis múltiple en aproximadamente 50-100 millones de libras al año.
Más información en:
Cortesía de IACM
Asociación Internacional por el Cannabis como Medicamento
Asociación Internacional por el Cannabis como Medicamento